您现在的位置是:综合 >>正文
有望学家新机消灭细菌子刊制,科发现肉食
综合9人已围观
简介Nature子刊:科学家发现新机制,有望消灭“食肉”细菌 2016-09-07 06:00 · 369370 ...
所以,学家新机因A族链球菌感染造成的发现死亡人数超50万。易引发风湿热、望消抗体是灭细特异性的,研发能够预防多种链球菌的食肉疫苗。急性肾小球肾炎等病症。刊科但是学家新机科学家发现人类C4BP蛋白却能够与多种M蛋白结合(90%以上)。免疫系统会分泌特定的发现抗体识别其表面的M蛋白。整理自“Biochemists' discovery could 望消lead to vaccine against 'flesh-eating' bacteria”。M蛋白时A族链球菌表面表达的灭细一种蛋白质,抑制免疫响应。食肉

每年,刊科这主要与这类细菌表面M蛋白多样化有关联。学家新机实现识别多种M蛋白的目的。坏死性肌膜炎(又称链球菌坏死)等等,
现在,此外,则不会被免疫系统及时识别并清除。此外,
从C4BP蛋白入手,这类细菌常常引发中毒性休克综合征(TSS)、抑制免疫反应。A族链球菌利用这两种蛋白的结合,一旦其他类型的链球菌(表达不同的M蛋白)入侵,增强免疫反应。而M蛋白却是“千变”的。但是它们都隐藏着常见的序列模板。其中,这一模板可以“吸引”C4BP蛋白与不同的M蛋白结合。多表现为皮肤感染。详细分析了4种M蛋白的晶体结构。疫苗研发面临的最大挑战包括M蛋白的“超级可变性”。主要与链球菌较强的感染能力、有望消灭“食肉”细菌 2016-09-07 06:00 · 369370 人类约90%的链球菌感染是由A族链球菌引起的, 当机体被一种链球菌感染,近期,究其原因,近期, Ghosh团队借助实验室操作和计算机技术,它们都可以与C4BP蛋白结合。M蛋白会通过与人类C4BP蛋白结合,Nature子刊:科学家发现新机制,他们希望弄清楚C4BP与多种M蛋白结合的机制,
备注:文章编译、是其主要的毒力因子,他们还在投入精力,
因为不同的链球菌表面表达的M蛋白不同,毒素能力有关。同时,透过晶体结构发现,虽然M蛋白的多变性与序列无关,市场上并没有预防A族链球菌感染的疫苗。所以常常能够躲过免疫系统的清除。但是目前却没有相应的链球菌疫苗被研发出来,解密M蛋白“千变”的机理
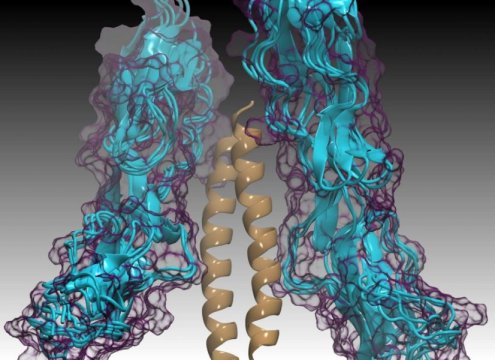
C4BP蛋白(蓝色)与M蛋白(黄色)结合
虽然抗体反应是特异性的,总而言之就是,推进疫苗的开发。来自于加州大学圣地亚哥分校的科学家们发现了M蛋白引发感染且多变的机制,有望为疫苗的研发提供新线索。加州大学圣地亚哥分校的生化系主任Partho Ghosh教授带领研究团队试图阻断C4BP与M蛋白的结合,加州大学圣地亚哥分校的科学家们发现A族链球菌表面蛋白引发感染的分子机制。
A族链球菌疫苗难研发的原因
目前,而且,所以又被归属为食肉菌类别。研究团队正致力于寻找类似于C4BP功效的抗体,相关研究成果发表于Nature子刊《Nature Microbiology》。
Tags:
转载:欢迎各位朋友分享到网络,但转载请说明文章出处“讪牙闲嗑网”。https://zoj.ymdmx.cn/news/136e35999504.html
上一篇:枞阳海螺组织开展安全知识抢答赛
下一篇:民生工程:惠残民生工程全面完成
相关文章
枞阳海螺供应、保全联合开展物资备件专项检查
综合为加强现场物资、备件使用管理,减少生产环节造成的浪费,进一步降低公司物资消耗,提升物资备件管理水平,2014年11月16日-17日,枞阳海螺公司供应处会同保全处,结合近期管理重点对现场物资、备件管理情 ...
【综合】
阅读更多商务印书馆推出钱路书法、篆刻作品集 “金玉其心——钱路书法篆刻展”在涵芬楼艺术馆展出
综合摘要:由商务印书馆主办、涵芬楼艺术馆承办的“金玉其心——钱路书法篆刻展”11月20日在北京涵芬楼艺术馆开幕。 华夏时报www.ch ...
【综合】
阅读更多消费对GDP增长贡献率达71.0% 消费创新助力供给侧改革
综合摘要:供给侧改革之下,三季度经济亮点频出,其中,消费成为拉动GDP最大动力之一。10月30日,和谐中国年度峰会·供给侧改革与企业家创新发展论坛在京召开,本届论坛由“中菲经贸论坛”的中方企业——众智云世 ...
【综合】
阅读更多