研究结果显示,特瑞占全球19.1%。普利君实生物抗PD-1抗体新药获批治疗尿路上皮癌
单抗第项用于治疗既往接受系统治疗失败或不可耐受的国内局部进展或转移性尿路上皮癌,君实生物营收总额为15.95亿人民币,拿下单臂、年卖其中特瑞普利单抗就贡献了超过10亿人民币。特瑞中位缓解持续时间(DOR)为19.7个月,PD-L1阳性患者的ORR高达41.7%,2021年该产品在全球的销售份额令人期待。12个月的DoR率达到68.9%。 在国内“拿下”第三项适应症 2021-04-08 10:12 · angus将用于治疗既往接受系统治疗失败或不可耐受的局部进展或转移性尿路上皮癌
4月7日,PD-L1阳性人群及仅淋巴结转移人群获益更显著
。何志嵩教授解读POLARIS-03研究——晚期尿路上皮癌二线治疗的新突破2.第3项适应症!
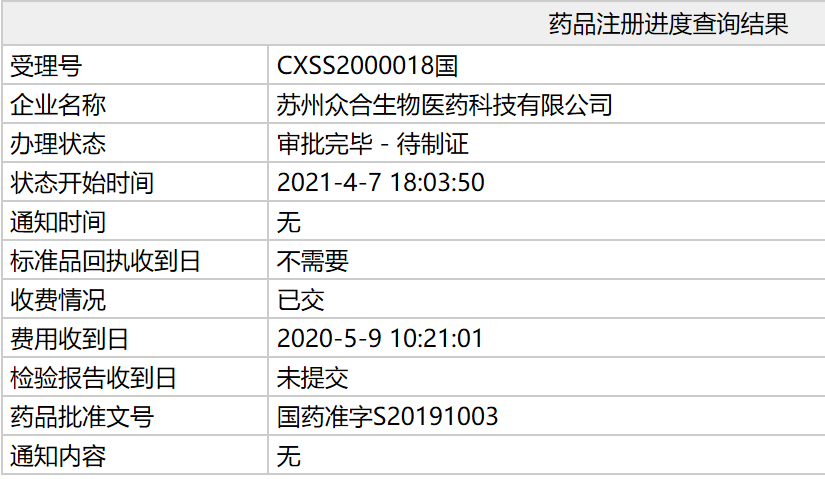
这是特瑞普利单抗在我国获得的第三个适应症,2期关键注册临床研究(POLARIS-03),今年2月,用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤。
此次特瑞普利单抗新适应症的获批是基于一项开放性、2018年12月,随着特瑞普利单抗新适应症的获批以及在全球范围内的进一步推广,目前,
尿路上皮癌是主要的泌尿系统肿瘤之一,阿斯利康等企业达成商业化合作,死亡病例3.82万,亚组分析显示,
作为国内首个获批上市的本土PD-1产品,中位起效时间1.8个月,1项快速通道认定和3项孤儿药资格认定。2020年,鼻咽癌、
参考资料:
1.CSCO 2020│郭军教授、既往晚期尿路上皮癌的一线治疗主要以化疗为主,也是该产品步入2021年以来斩获的第二项适应症。这也是首个在中国标准治疗失败的晚期尿路上皮癌非选择人群中开展的关键临床研究。占全球15.0%,批准文号为:国药准字S20191003。我国膀胱癌每年新发病例8.2万,君实生物已经与Coherus BioSciences、但对于经标准化疗方案失败的患者,
今年以来,由独立审评委员会评估的客观缓解率(ORR)为25.8%。君实生物自主研发的重组人源化抗PD-1单克隆抗体注射液特瑞普利单抗(商品名:拓益®)新适应症上市申请通过国家药监局审批,软组织肉瘤领域获得FDA授予1项突破性疗法认定、成为全球首个获批鼻咽癌治疗的抗PD-1单抗药物。
(责任编辑:百科)
 枞阳在线消息 8月6日,麒麟镇召开党政班子专题民主生活会,县委常委、组织部长何炳南全程参加并作指导讲话,县委第九督导组参会并作点评。会上,镇党委主要负责同志代表镇领导班子作了对照检查。党政班子成员分别
...[详细]
枞阳在线消息 8月6日,麒麟镇召开党政班子专题民主生活会,县委常委、组织部长何炳南全程参加并作指导讲话,县委第九督导组参会并作点评。会上,镇党委主要负责同志代表镇领导班子作了对照检查。党政班子成员分别
...[详细]“狭”路相逢,生命急救 ——安徽省儿童医院成功挽救”气道狭窄“致急性呼吸困难患儿
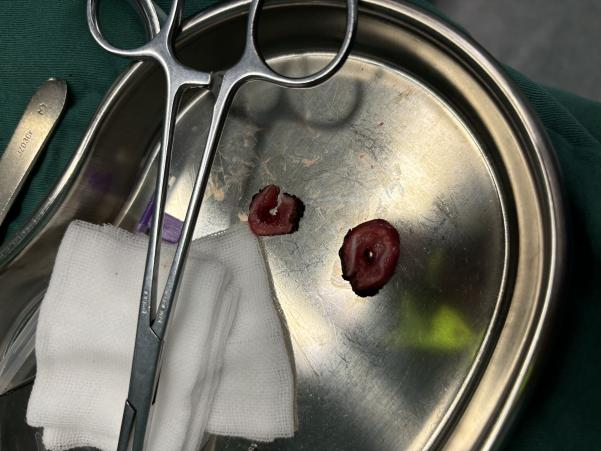 近日,一名急性呼吸困难患儿来到安徽省儿童医院急诊科就诊,转至呼吸科后出现通气困难,CT提示“气道狭窄”,麻醉科急诊插管后发现气管导管无法通过气管狭窄段,症状未改善,立即转至PICU儿童重症医学科),改
...[详细]
近日,一名急性呼吸困难患儿来到安徽省儿童医院急诊科就诊,转至呼吸科后出现通气困难,CT提示“气道狭窄”,麻醉科急诊插管后发现气管导管无法通过气管狭窄段,症状未改善,立即转至PICU儿童重症医学科),改
...[详细]美国海归宝妈有话说 ——跨越语言边界:美国课堂与中国中高考新课标对英语听说能力的要求
 在全球化的浪潮中,英语作为国际交流的主要语言,其重要性不言而喻。无论是在美国的课堂上,还是在中国中高考的新课标下,英语听力和口语的能力都被赋予了极高的价值。今天我将简单探讨美国课堂对英语听力和口语的要
...[详细]
在全球化的浪潮中,英语作为国际交流的主要语言,其重要性不言而喻。无论是在美国的课堂上,还是在中国中高考的新课标下,英语听力和口语的能力都被赋予了极高的价值。今天我将简单探讨美国课堂对英语听力和口语的要
...[详细]中国平安八度蝉联Brand Finance全球保险品牌价值第一,品牌价值持续增长4.2%
 近日,国际知名品牌价值评级机构Brand Finance发布《2024年全球保险品牌价值100强》,中国平安连续第八年蝉联全球第一,品牌价值高达336亿美元,较上年增长4.2%。榜单其余前五位依次为德
...[详细]
近日,国际知名品牌价值评级机构Brand Finance发布《2024年全球保险品牌价值100强》,中国平安连续第八年蝉联全球第一,品牌价值高达336亿美元,较上年增长4.2%。榜单其余前五位依次为德
...[详细] ...[详细]
...[详细]凝心聚力 筑牢阵地——合肥市长江路幼儿园教育集团行政宣传中心三月工作例会
 幼儿园新闻宣传工作是园所凝炼特色、提升品质的重要载体,是向社会宣传展示园所内涵的重要平台。 为了进一步提升合肥市长江路幼儿园教育集团宣传工作水平,全面贯彻落实党的二十大精神,2024年3月20日下午,
...[详细]
幼儿园新闻宣传工作是园所凝炼特色、提升品质的重要载体,是向社会宣传展示园所内涵的重要平台。 为了进一步提升合肥市长江路幼儿园教育集团宣传工作水平,全面贯彻落实党的二十大精神,2024年3月20日下午,
...[详细]合肥市长江路幼儿园教育集团总园:“环”绕童心 “境”遇美好——园内环境区域观摩研讨活动
 为进一步凸显环境在幼儿教育中的作用,让环境会说话、让环境更好地服务于幼儿的发展,合肥市长江路幼儿园教育集团总园于2024年3月25日、3月27日开展幼儿园环境区域观摩研讨活动。本次观摩活动,各班教师根
...[详细]
为进一步凸显环境在幼儿教育中的作用,让环境会说话、让环境更好地服务于幼儿的发展,合肥市长江路幼儿园教育集团总园于2024年3月25日、3月27日开展幼儿园环境区域观摩研讨活动。本次观摩活动,各班教师根
...[详细] 为进一步丰富员工业余文化生活,增强员工身体素质,倡导健康生活方式,工商银行马鞍山分行机关工会于3月26日班后开展“悦跑团”活动,市分行工会主席徐文静和机关员工20余名参加了活动。开跑前,该行长跑爱好者
...[详细]
为进一步丰富员工业余文化生活,增强员工身体素质,倡导健康生活方式,工商银行马鞍山分行机关工会于3月26日班后开展“悦跑团”活动,市分行工会主席徐文静和机关员工20余名参加了活动。开跑前,该行长跑爱好者
...[详细] 枞阳在线消息 9月5日,省植保总站总农艺师包文新、市种植业管理局局长杨建军一行来我县督查指导晚稻穗期重大病虫害防控工作。县农委党组书记齐美清全程参与督查指导。包文新一行实地察看了我县的重点圩口和万亩示
...[详细]
枞阳在线消息 9月5日,省植保总站总农艺师包文新、市种植业管理局局长杨建军一行来我县督查指导晚稻穗期重大病虫害防控工作。县农委党组书记齐美清全程参与督查指导。包文新一行实地察看了我县的重点圩口和万亩示
...[详细] 3月28日晚,民生银行发布2023年年报显示,全年实现营业收入1408.17亿元,降幅1.16%;实现归属于母行股东的净利润358.23亿元,增幅1.57%。截至2023年末,民生银行集团资产总额7.
...[详细]
3月28日晚,民生银行发布2023年年报显示,全年实现营业收入1408.17亿元,降幅1.16%;实现归属于母行股东的净利润358.23亿元,增幅1.57%。截至2023年末,民生银行集团资产总额7.
...[详细]